Nesta seção apresentaremos um resumo histórico sobre a evolução da química quântica.
1) Teoria Atômica
![]() - Grécia antiga ®
Alquimistas (400 A.C.)
- Grécia antiga ®
Alquimistas (400 A.C.)
Matéria consiste
de partículas distintas indivisíveis (átomos)
Ausência de
evidências experimentais.
![]() -Teoria Atômica dos
Gregos
-Teoria Atômica dos
Gregos
Em 430 A. C. Leucipo
formula a primeira teoria científica sobre a composição
da matéria. Em 400 A. C Demócrito confirma esta teoria de
que a matéria é constituída por partículas
minúsculas e indivisíveis. Em 300 A. C. Epicuro continua
a sustentar a teoria atômica de seus antepassados assim como Lucrécio,
entre os romanos, em 90 A. C.
![]() -Alquimia
-Alquimia
Os árabes herdaram,
na Idade Média, a cultura do mundo antigo e, no que diz respeito
à química, aprofundaram-se no desenvolvimento da alquimia.
Na busca da Pedra Filosofal que transformaria tudo em Ouro, ou ainda do
Elixir da Longa Vida, os alquimistas acumularam grande experiência
em diversos processos, que foram muito úteis na evolução
da química através dos tempos.
![]() - Século XVIII ®
Antoine Lavoisier (1789)
- Século XVIII ®
Antoine Lavoisier (1789)
Química como
ciência quantitativa (conservação de massa no decorrer
de uma reação química).
| Lei da Conservação da Massa : Não há alteração detectável na massa numa reação química comum. |
![]() -Antes de 1800, o conceito
da natureza discreta da matéria foi baseada, em grande parte, em
intuição.
-Antes de 1800, o conceito
da natureza discreta da matéria foi baseada, em grande parte, em
intuição.
![]() - Lei das combinações
volumétricas (Gay-Lussac, 1808)
- Lei das combinações
volumétricas (Gay-Lussac, 1808)
![]() - Dalton, por volta de 1808,
em sua teoria atômica veio a explicar várias dessas leis empíricas
e intuitivas.
- Dalton, por volta de 1808,
em sua teoria atômica veio a explicar várias dessas leis empíricas
e intuitivas.
![]() - Os três postulados
principais da teoria atômica de Dalton são:
- Os três postulados
principais da teoria atômica de Dalton são:
| 1)- A Natureza Discreta da Matéria: Um elemento é composto por minúsculas partículas denominadas átomos. Todos os átomos de um determindado elemento químico apresentam as mesmas propriedades. |
| 2)- Lei da Conservação de Massa: Átomos de elementos diferentes apresentam propriedades diferentes. Em uma reação química comum, nenhum átomo de qualquer elemento desaparece ou transforma num átomo de outro elemento. |
| 3)- Lei da Composição Constante: Compostos são formados pela combinação de átomos de dois ou mais elementos. Em um determinado composto, os números relativos de átomos de um certo tipo são definidos constantes. De um modo geral, estes números relativos podem ser expressos como números inteiros ou frações simples. |
![]() - O terceiro postulado levou
Dalton a formular a Lei das Proporções da Múltiplas:
- O terceiro postulado levou
Dalton a formular a Lei das Proporções da Múltiplas:
| A massa de um elemento que se combina com uma massa fixa de um segundo elemento o faz segundo uma razão de números inteiros. |
![]() - Século XIX - Lei
das proporções definidas (Proust)
- Século XIX - Lei
das proporções definidas (Proust)
| Em uma substância química pura, os elementos estão sempre presentes em proporções definidas em termos de massa. |
![]() - Helmoholtz (1811)
- Helmoholtz (1811)
| Tanto a eletricidade positiva quanto a negativa estão dividida em proporções elementares definidas. |
![]() - Avogadro (1811), distinguiu
o átomo com sendo a menor partícula que pode participar
- Avogadro (1811), distinguiu
o átomo com sendo a menor partícula que pode participar
de uma reação química
e a menor partícula que pode existir permanentemente.
![]() - Faraday (1832) ®
Leis da eletrólise
- Faraday (1832) ®
Leis da eletrólise
![]() - J. J. Thompson (1897)
®
Descoberta do elétron
- J. J. Thompson (1897)
®
Descoberta do elétron
![]() - Modelo de Thompson (1904)
- Modelo de Thompson (1904)

Modelo atômico de Thompson
![]() - Modelo de Rutherford (1911),
comprovado experimentalmente
- Modelo de Rutherford (1911),
comprovado experimentalmente

Modelo atômico de Rutherford
|
|
|---|
![]() - Millikan (1913) ®
Medida direta da carga do elétron.
- Millikan (1913) ®
Medida direta da carga do elétron.
2)- A Natureza da Luz
![]() Século XVII ®
Controvérsia entre Isaac Newton na Inglaterra e Huygens na Holanda.
Século XVII ®
Controvérsia entre Isaac Newton na Inglaterra e Huygens na Holanda.
Newton® As propriedades da luz poderiam ser explicadas se ela fosse constituida de corpúsculos.
Huygens® A luz era um movimento ondulatório do éter, um meio imaterial que enchia o universo.
Confirmação da teoria ondulatória
![]() Young (1801) ®
Experiências de interferência da luz
Young (1801) ®
Experiências de interferência da luz
![]() Fresnell (1815) ®
Experiências de difração da luz
Fresnell (1815) ®
Experiências de difração da luz
Interferência
por Difração (fenda única)
Modo
de usar: Com o botão esquerdo do mouse você pode variar
o
comprimento de onda (variando as cores), assim como modificar a abertura
da fenda
© Copyright 1997, Sergey
Kiselev and Tanya Yanovsky-Kiselev
Last modified: June 20, 1997
![]() Malus (1808) ®
Descobriu o efeito de polarização à direção
da luz ou ondas luminosas eram distúrbios
Malus (1808) ®
Descobriu o efeito de polarização à direção
da luz ou ondas luminosas eram distúrbios
perpendiculares à direção de
movimento do feixe de luz.
![]() Maxwell (1864) ®
Desenvolveu uma teoria eletromagnética para a luz, confirmada experimentalmente
em 1887.
Maxwell (1864) ®
Desenvolveu uma teoria eletromagnética para a luz, confirmada experimentalmente
em 1887.
A simulação abaixo representa
a propagação de uma onda eletromagnética
na direção Z. Veja que os campos
E e B são sempre ortogonais.
Propagação de uma Onda Eletromagnética
![]() Michelson e Morley (1887)
®
Realizou experiências que demonstraram a não existência
do éter.
Michelson e Morley (1887)
®
Realizou experiências que demonstraram a não existência
do éter.
3) A Luz e a Teoria Quântica
![]() Max Planck (1900)
®
Ressuscitou o modelo corpuscular da luz quando
Max Planck (1900)
®
Ressuscitou o modelo corpuscular da luz quando
apresentou uma teoria explicando a radiação
do corpo negro.
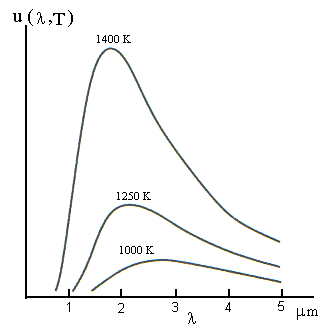
Espectro da radiação de um corpo negro
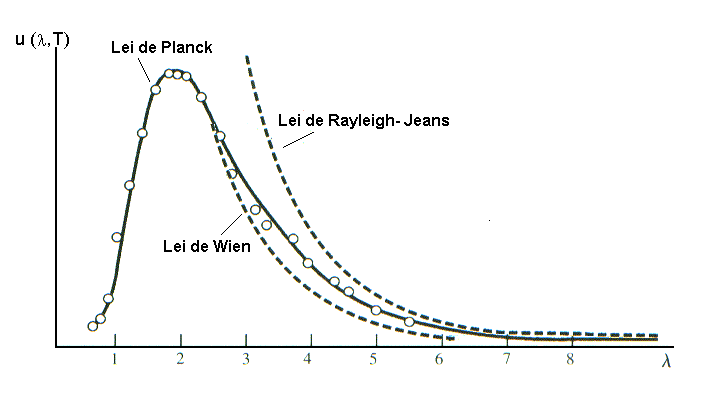
Tentativas para a explicação do Corpo Negro
Planck assumiu que a energia da radiação eletromagnética emitida fosse quantizada em unidades de hn. Estas quantidades discretas de energia, foram chamadas de quanta de energia, sendo que um quantum de luz de freqüência equivalente a hn.
Segundo
Planck, o material constituinte da superfície emissora do corpo
negro era como que composto de pequenos osciladores que, ao oscilarem,
emitiam radiações eletromagnéticas, cuja energia En
era dada por , En = n hn,
sendo n = 1, 2, 3,… e n seria a freqüência
associada a uma dada oscilação (comportamento descontínuo
do mundo atômico). Estes pequenos pacotes de luz foram mais tarde
chamadas de fótons.
O Efeito Fotoelétrico
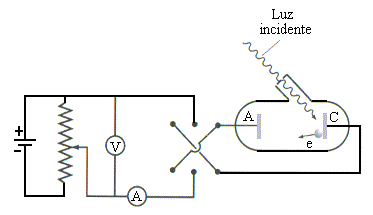
Efeito Foto-elétrico
Einstein (1905), utilizando as idéias de Planck mostrou que a energia cinética dos fotoelétrons = hn- Ee , onde Ee é a energia de ligação necessária para arrancar um elétron de um átomo.
Energia Cinética do fóton E = hn= mc2 = (mc)c ~ pc onde p é o momento do fóton, então
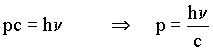
como 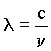 , então
, então  o que leva ao conceito dualístico onda-corpúsculo da luz.
o que leva ao conceito dualístico onda-corpúsculo da luz.
A luz que experimentalmente possui um comprimento de onda l
= c/n comporta-se como uma partícula
que tem um momento p = h/l . Assim sendo, Einstein
e Planck vieram conciliar, de certa forma, as teorias de Newton e Maxwell
para a luz.
4) A Teoria Quântica
O Modelo Atômico de Bohr (1913)
Já se conhecia, experimentalmente, as séries espectrais do átomo de hidrogênio e calculadas empiricamente pela fórmula de Balmer-Rydberg e Ritz (1896),
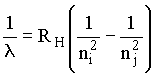
sendo os números quânticos n números inteiros. RH = 110.500 cm-1.
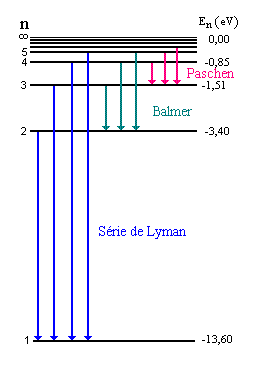
Espectro de radiação do átomo de hidrogênio
Séries Espectrais
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
- Como relacionar o espectro emitido por um átomo com a sua estrutura ?
- Como resolver o problema da instabilidade do modelo nuclear de Rutherford ?
Modelo de Bohr
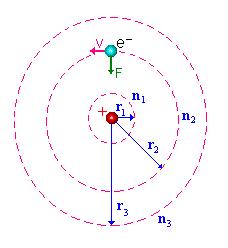
Átomo de Bohr
Postulados
1)- O elétron pode mover-se ao redor do núcleo, em certas órbitas bem definidas
2)- Estas órbitas permitidas correspondem aos estados estacionários definidos do átomo e, em tais estados, o átomo é estável e não irradia.
3)- Na transição de um elétron de uma órbita estável para outra, há absorção ou emissão de energia, sendo a freqüência da radiação dada por hn = DE onde DE é a diferença de energética entre os dois estados estacionários e h é a constante de Planck.
Como escolher estas órbitas ? A condição imposta é que
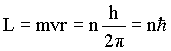
onde n = 1, 2, 3….
Diferença de energia entre dois estados
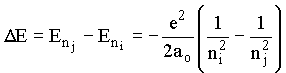
e pelo terceiro postulado:
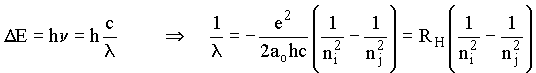
Falhas neste modelo
- Resultados incorretos para átomos ou íons com mais de dois elétrons
- Não explica o problema da ligação química
Dualidade Onda - Corpúsculo
Luiz de Broglie (1924) sugeriu que assim como as ondas de luz tinham propriedades de partículas o inverso também deveria ser válido, isto é a toda partícula de momento p estaria associada a uma onda de comprimento l = h/p, que foi verificado experimentalmente por Davisson e Gerner (1927) usando difração de um feixe de elétrons em um cristal de níquel, calculando com isto o comprimento de onda dos elétrons.
Para Bohr, o elétron do hidrogênio só poderia existir em certas órbitas que confeririam estabilidade ao átomo e que seriam caracterizadas por um certo número quântico.
Para de Broglie, as órbitas estáveis do átomo de Bohr, corresponderiam a ondas estacionárias onde o perímetro da órbita era um múltiplo inteiro do comprimento de onda do elétron, isto é,
![]()
A idéia de onda estacionária corresponde ao perímetro da órbita era necessária, pois do contrário, as ondas se destruiriam por simples interferências. Segundo De Broglie l = h/p, então
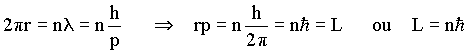
o que corresponde à hipótese de Bohr (momento angular quantizado em múltiplos de h/2p ).
Com De Broglie e Einstein, introduziu-se assim o caráter dualístico da natureza. Na natureza os fenômenos se manifestam então ora com propriedades e características de partículas, ora com propriedades e característica de ondas.
A existência de ondas de matéria sugeria a possibilidade de se construir uma equação de onda que explicasse naturalmente o comportamento dos elétrons, átomos e moléculas.
Equação de Onda Clássica Tridimensional
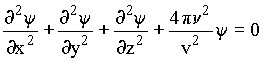
onde y é a função de onda, n é a freqüência da onda e v é a velocidade de propagação.
Transformação para uma equação não clássica
Da equação de De Broglie  ,
tiramos que
,
tiramos que
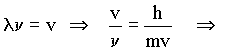
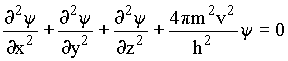
Como a energia cinética é dada por 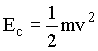 ,
temos que
,
temos que
![]()
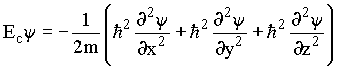
Classicamente
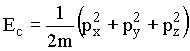
Postulado de Schrödinger
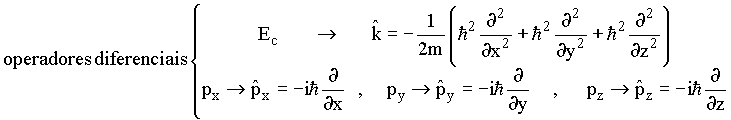
A energia total seria
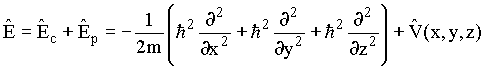
ou seja, em termos de operadores ![]() que é conhecida como equação de Schrödinger,
a qual é o análogo mecânico-quântico da equação
clássica
que é conhecida como equação de Schrödinger,
a qual é o análogo mecânico-quântico da equação
clássica ![]() .
.
Usualmente ![]() é escrita por
é escrita por ![]() .
.
Significado da Função de Onda
A função de
onda y não possui significado físico,
mas o quadrado de seu módulo ![]() ,
onde y* é o conjugado imaginário
de y , respresenta a probabilidade de encontrar
a partícula próxima ao ponto especificado pelas coordenadas
(x,y,z). Então a probabilidade de encontrar a partícula em
um volume V do espaço é dado por
,
onde y* é o conjugado imaginário
de y , respresenta a probabilidade de encontrar
a partícula próxima ao ponto especificado pelas coordenadas
(x,y,z). Então a probabilidade de encontrar a partícula em
um volume V do espaço é dado por
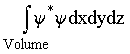
Se o volume V é infinito, ele contém certamente a partícula; então ,

Esta
condição fundamental chamada de normalização
da função de onda exige que esta seja de quadrado somável
e em particular que ela tenda a zero no inifinito.
Sistemas Moleculares e Sólidos
Com a introdução a teoria quântica foi possível
compreender estruturas com vários átomos, isto é as
moléculas e os sólidos em geral.
|
|
|
O conteúdo desta página está em constante atualização.
Correções no texto e sugestões serão bem vindas.
![]() Electronic
Address :
kcmundin@unb.br
Electronic
Address :
kcmundin@unb.br
Last Updated: Jul/17/2002
Copyright 1997: Kleber
C. Mundim. All rights reserved.
Register No 169.766 -
Biblioteca Nacional - Ministério da Cultura
phone: 55 61 307 2150